アレニウスの定義:酸の定義
1887年スウェーデンのアレニウスは酸を次のように定義しました。
酸とは水溶液中で水素イオンH+を生じる水素化合物である。
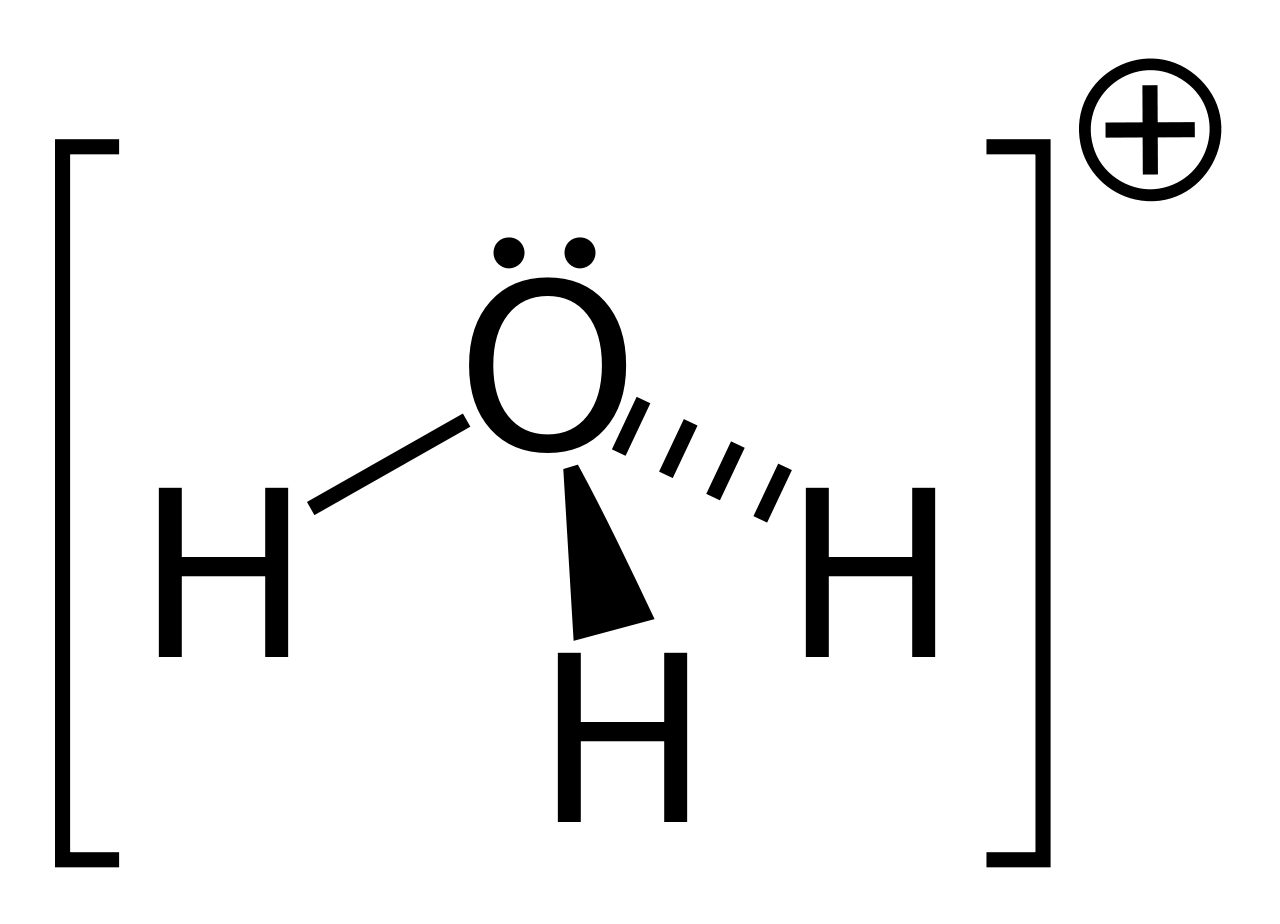
このH+とは、H原子から電子が失われたもので、プロトン(陽子)そのものです。その後の研究により、このプロトンは、水分子と配位結合してオキソニウムイオンH3O+として存在していることがわかりました。
なぜ配位結合するの?
水素イオンの電荷密度は強く、普通の極性のあるイオンならば水和する程度ですが、H+は水分子を強く引き付けて配位結合をします。
本当はH9O4+として存在する
また、最近の研究によると、オキソニウムイオンH3O+はさらに3つの分子の水が結合して、H9O4+として存在していることもわかってきました。しかし、H9O4+と書くと式が非常に煩雑になるため、通常は書きません。
アレニウスの定義:塩基の定義
また、アレニウスは塩基については次のように定義しました。
塩基とは、ヒドロキシ基を持ち、水溶液中で水酸化物イオンOH-を放出する物質である。
アルカリと塩基の違い
アルカリとは塩基性の水溶液のことを指します。特に、アルカリ金属やアルカリ土塁金属の水酸化物のように水に溶けやすい物質をアルカリと呼びます。しかし、それ以外の水酸化物は殆ど水には溶けませんが、酸と中和反応を行える物質を全部ひっくるめて「塩基」と呼んでいます。
なぜOH-を放出するの?
NaOHなどは、イオン結合でできた物質で、極性分子である水に囲まれて水和し、Na+とOH–がバラバラになります。酸の一種であるCH3COOHなどは僅かしか電離していませんが、水に溶ける塩基は殆ど全て電離しています。
アレニウスの定義の欠点
アレニウスの定義では、酸・塩基の一部分を説明していたに過ぎませんでした。次のような欠点があります。
- 水溶液以外の酸・塩基反応を説明できない。
- 水に溶けないFe(OH)3が塩基であることを説明できない。
- ヒドロキシ基を持たないアンモニアが塩基であることを説明できない。
ブレンステッドの定義
ブレンステッドは、水が存在しなくても酸・塩基反応が説明できるよう、次のように酸・塩基を定義しました。
酸とはプロトンH+を相手に与えることができる物質である。
塩基とはプロトンH+を相手から受け取ることのできる物質である。
この定義によると、例えばHClとNH3の反応では次の反応が起こります。
結果、H+を供給するHClは酸、H+を受け取るNH3は塩基となります。
また、CH3COOHとH2Oの反応においても、酸と塩基を区別できます。
結果、H+を供給するCH3COOHは酸、H+を受け取るH2Oは塩基となります。
アンモニアNH3はOH基を持ちませんが、水と反応することによってOH–を生じます。
結果、H+を供給するH2Oは酸、H+を受け取るNH3は塩基となります。
このように、水はブレンステッドの定義によると、相手の物質によって酸にも塩基にもなります。
共役の酸・塩基
酸HAがH+を放出してできたA–は、逆の見方をするとH+を受け取ることができます。このように、HAとA–は互いに共役の酸・塩基であるといいます。
実際には、平衡はどちらかに右側に偏ります。これは、HAがHBよりも酸としての性質が強いことを意味しています。
なぜ濃硫酸は酸性が弱いの?
濃硫酸単体では、H+を放出する相手がいないため、H+が遊離の状態で殆ど存在しません。結果、酸性は弱くなります。しかし、ある程度、水で薄めると、高い酸性を示すようになります。
