リンPとは?
リンは単体としては自然界に存在せず、リン酸塩として地殻中に存在します。
黄リン・赤リンの生成方法
リン酸カルシウム(リン鉱石)に、珪砂(SiO2)とコークス(C)を混ぜて熱すると、リンの蒸気が発生します。これを冷やすと黄リンを得ることができます。
2Ca3(PO4)2 + 6SiO2 + 10C → 6CaSiO3 + 10CO + P4
この反応は次のように分解して考えると理解しやすいです。
2Ca3(PO4)2 ⇔ 6CaO + P4O10
CaO + SiO2 → CaSiO3
P4O10 + 10C → 10CO + P4
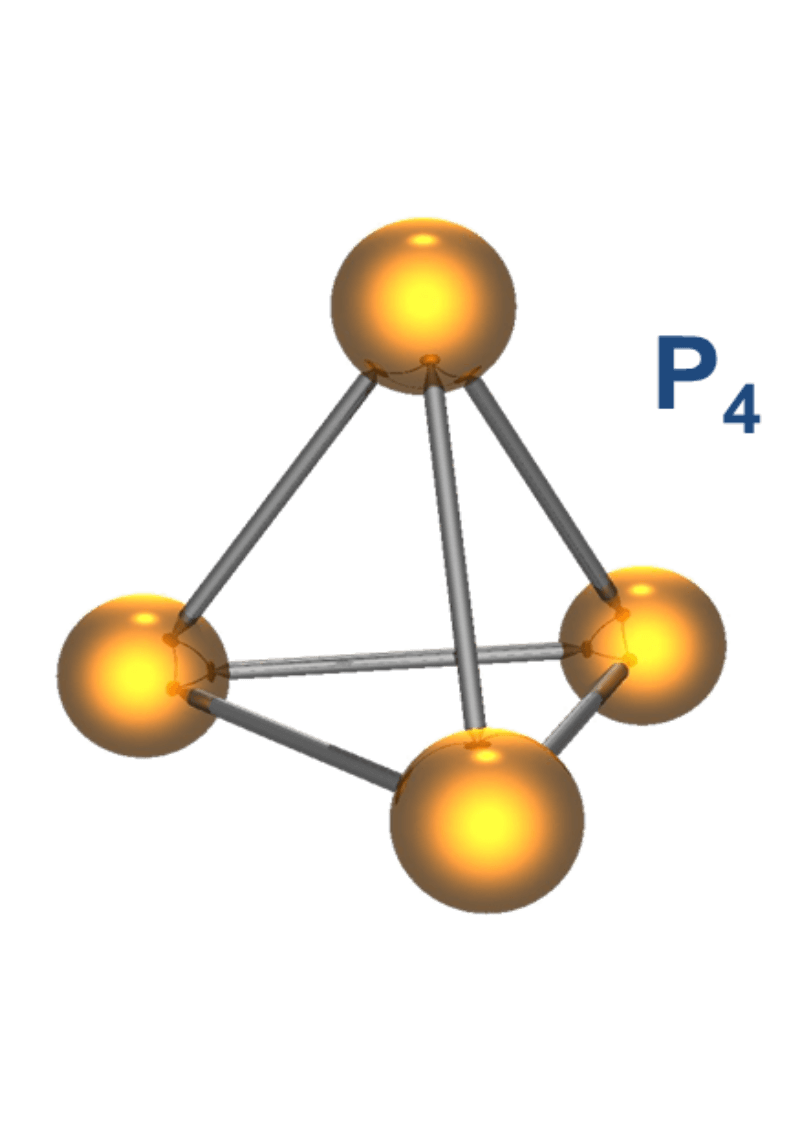
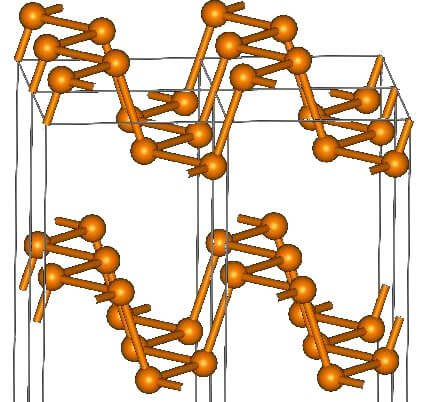
黄リンを空気を絶って熱すると赤リンに変化します。黄リンP4分子同士が重合した高分子化合物が赤リンです。
黄リンと赤リンの違い
次のような違いがあります。
| 黄リン | 赤リン | |
| 色 | 淡黄色 | 暗赤色 |
| 融点 | 44℃ | 590℃ |
| 発火点 | 50℃ | 260℃ |
| 毒性 | 極めて有毒 | 毒性は少ない |
| CS2への溶解性 | 溶ける | 溶けない |
| 構造 | P4分子 | Pn(巨大分子) |
| 発光 | 湿った空気中で発光する(リン光) | 発光しない。 |
| 用途 | 殺鼠剤・農薬 | マッチ |
なぜ黄リンは自然発火するの?
黄リンP4は結合角が60度と小さく、分子内に大きなひずみを持っています。
このひずみを解消しようと、PとPの間の結合が一部切れやすくなっており、不対電子を持つP原子(ラジカル)を生じます。このラジカルが酸素と反応し、酸化熱による発熱で、自然発火します。
一方、赤リンはP‐P結合が切れて重合し、ひずみが解消された構造を持っています。そのため、黄リンほど不安定な物質ではありません。しかし、発火点が低いため、マッチの側薬として利用されています。
黒リンとは?
黄リンを200℃、1.2×109Paで熱すると、黒リンを生じます。黒リンはP原子が規則的に配列した結晶で、金属光沢を持ちます。
十酸化四リンP4O10とは?
十酸化四リンは、リンを空気中で燃焼させることによって白煙として得ることができます。
4P + 5O2 → P4O10
十酸化四リンは吸湿性・脱水性が強く、乾燥剤として用いられます。水を加えて加熱するとリン酸H3PO4が生成されます。
リン酸H3PO4とは?
十酸化四リン酸に水を加えて熱することで得られます。リン酸は無色の結晶で潮解生があり、水によく溶けます。水溶液は酸性を示します。
リン酸二水素カルシウムCa(H2PO4)2とは?
リン酸カルシウムを硫酸と反応させると、リン酸二水素カルシウムを得ることができます。また、同時に硫酸カルシウムも生成され、このリン酸二水素カルシウムと硫酸カルシウムの混合物を過リン酸石灰と呼びます。過リン酸石灰はリン酸肥料として利用されています。
Ca3(PO4)2 + 2H2SO4 → Ca(H2PO4)2 + 2CaSO4
リン酸カルシウムは水に不溶性ですが、リン酸二水素カルシウムは水溶性であり、生物が吸収することができます。