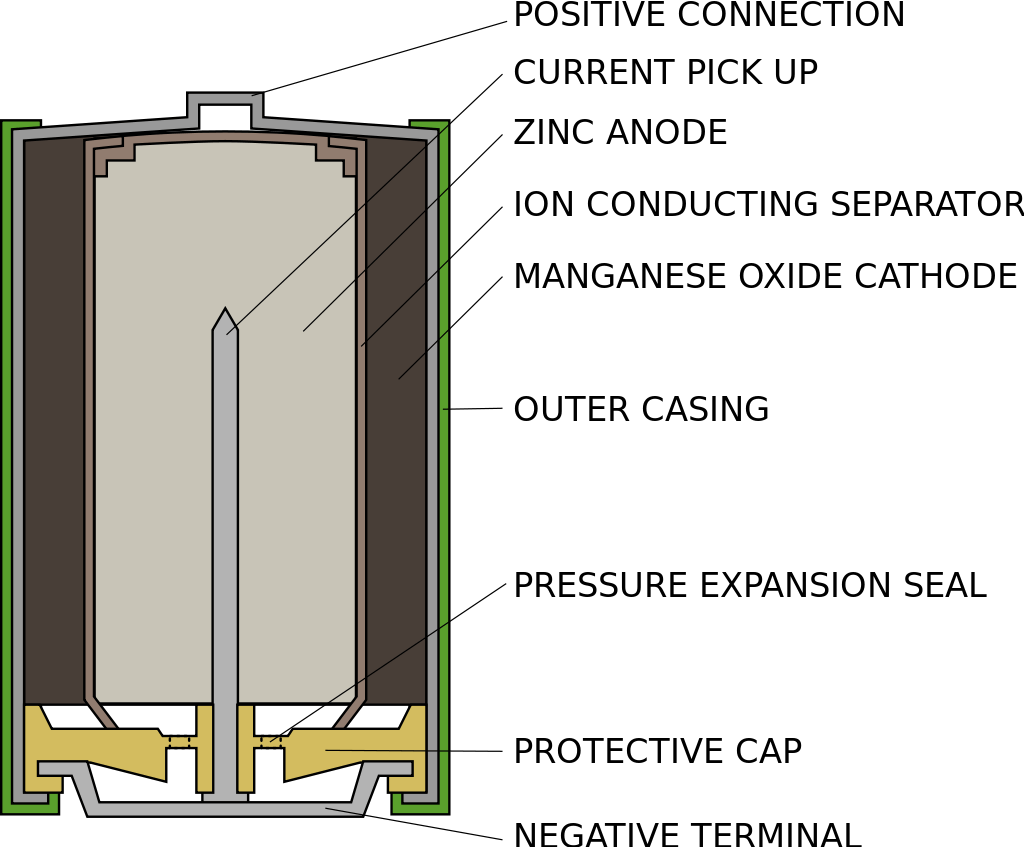
アルカリマンガン電池とは?
マンガン乾電池の電解液に、ZnOを飽和させたKOH水溶液を用いた電池をアルカリマンガン乾電池と呼びます。
KOHは水への溶解度が高いので、濃度が高い電解液を作ることができます。そのため、より少ない量で大量のZnを溶かすことができ、その結果、マンガン電池の2倍の放電量となります。また、KOHが高濃度のため、凝固点降下度も高くなり、-20℃でも使用可能です。
水銀電池・銀電池とは?
マンガン乾電池の正極活物質のMnO2の代わりに、HgOを用いたものを水銀電池、Ag2OやAgOを用いたものを銀電池と呼びます。
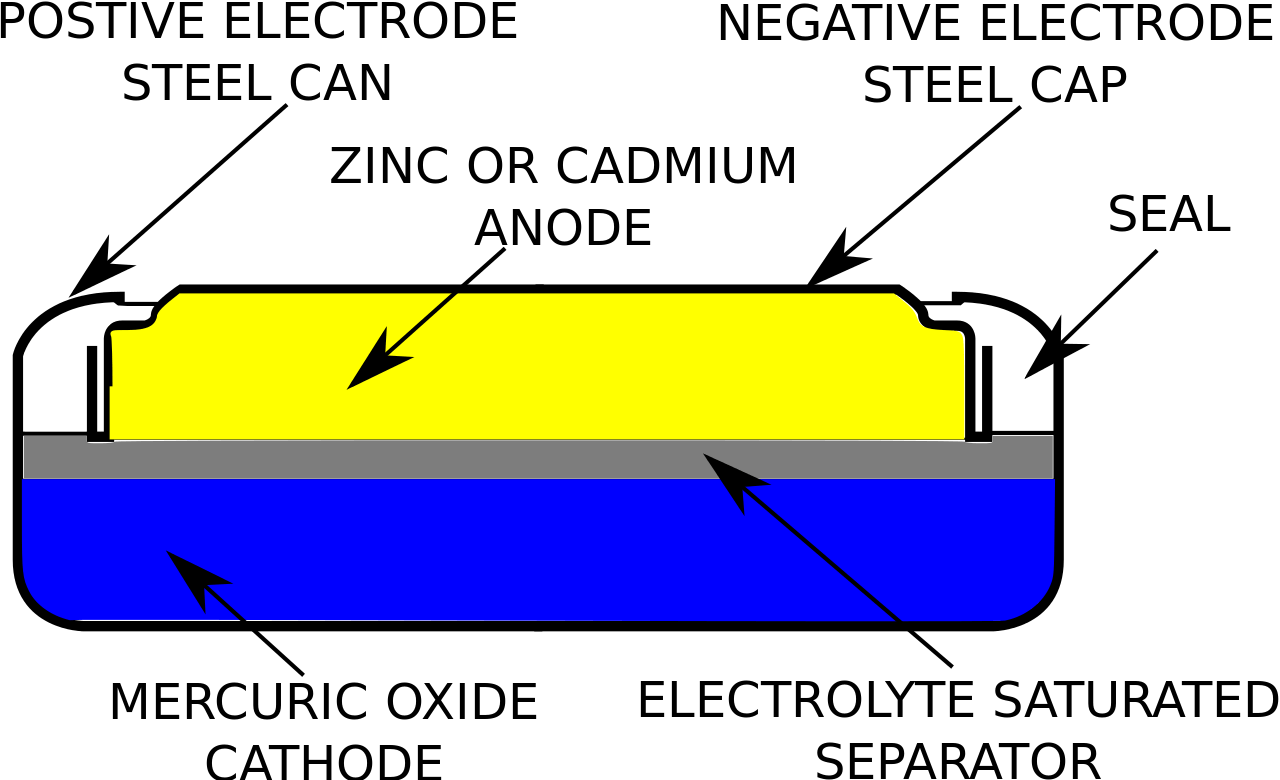
正極にはHgやAgが生じるため、正極合材の伝導性が向上します。そのため、黒鉛を加える必要が無く、体積を減少できます。水銀電池・銀電池はボタン電池として利用されています。水銀電池は有毒なHgが生成されるため、廃棄には注意が必要です。
ニッケル‐カドミウム蓄電池とは?
KOH水溶液に、負極活物質にカドミウムCd、正極活物質に酸化水酸化ニッケル(Ⅲ)NiO(OH)を浸したものをニッケル‐カドミウム蓄電池と呼びます。
両極では次の反応が起こります。
⊖極 Cd + 2OH- → Cd(OH)2 + 2e–
⊕極 NiO(OH) + H2O + e– → Ni(OH)2 + OH–
Cd(OH)2、Ni(OH)2は水に不溶のため、逆に電流を流すと逆反応が起こり充電が可能です。
燃料電池とは?
水素と酸素を用いて電気エネルギーを取り出す電池を燃料電池と呼びます。負極に水素、正極に酸素を供給し、電解液にKOHやH3PO4などを利用します。
電極にH2を吹き付けると、H2はイオン化し、電解液中にH+として溶けます。この時に、負極に電子が渡されます。負極に溜まった電子は正極へと移動し、O2が受け取り、O2-となります。その後すぐにH+と反応してH2Oになります。
水素(還元剤)と酸素(酸化剤)があれば電気を作り出すことができ、発電効率も40~45%と、火力発電(35%)よりも高いです。
リチウム電池とは?
リチウム電池は負極にイオン化傾向が最大であるLiを用いている電池です。」
Liは水と反応するため、電解質には有機溶媒を利用します。正極活物質には電子とLi+を収容できる酸化マンガンやフッ化黒鉛(CF)nなどが使われます。
⊖ Li | LiClO4 + 有機溶媒 | MnO2