酸化の定義Ⅰ:酸素を得る
次の反応では、CuはOと結合しており、これを酸化と呼びます。生成されたものを酸化物と呼びます。
また次の反応ではCuはOを失っています。これを還元と呼びます。
酸化還元反応の同時性
酸化が起こる時には必ず還元も起こります。下の反応では、Cuは還元されていますが、H2は還元されています。
このような酸化と還元が同時に起こる反応を、酸化還元反応と呼びます。
酸化の定義Ⅱ:水素を失う
次の反応では、硫化水素は水素原子を失っています。一方、O2は水素を得ています。
この場合、ある物質が水素を失う変化を酸化、水素を得る変化を還元と呼びます。
酸化の定義Ⅲ:電子を得る
次の反応では、マグネシウムと酸素が結合します。その際には電子の授受がなされます。
金属元素と非金属元素の結合ですから、イオン結合を形成します。
2Mg → 2Mg2+ + 4e–
O2 + 4e– → 2O2-
Mgは電子を失い、Oは電子を得ます。このように物質が電子を失うと酸化された、電子を得ると還元されたと言います。
酸化の定義は「酸素を得る」→「水素失う」→「電子を失う」と拡張されてきましたが、現在では電子の授受が酸化還元の定義であるとされています。電子の授受を基本に考えることにより、より広範囲な酸化還元反応を説明できるようになるためです。
酸化数とは?
イオン結合からなる物質は電子の授受がはっきりしており理解しやすいです。しかし、共有結合からなる物質は、電子の授受がどのように起こったのかを判別するのは難しいです。
そのため、物質中の原子・イオンに対して、酸化数という数値を考えました。酸化数とは、1個の原子の酸化の程度を示した数値です。
中性の場合を0
電子を失った場合を+n
電子を得た場合を-n
イオン結合性物質の酸化数
イオンの電荷はそのまま電子の授受を示しているため、その電荷が酸化数となります。
共有結合性物質の酸化数
共有結合では、電子は完全には移動していません。しかし、電気陰性度の違いにより、共有電子対が電気陰性度が大きい原子に引き寄せられています。非共有電子対が完全に引き寄せられたと仮定し、その電荷を酸化数とみなしています。
例えば、H2Oでは、電気陰性度が高いOにHの原子が引き寄せられています。
2H → 2H+ + 2e–
O + 2e– → O2-
※完全に電子が引き寄せられたと仮定しています。実際はイオンの状態では存在していません。
そのため、Oの酸化数は-2、Hの酸化数は+1となります。
CO2では、電気陰性度が高いOにCの原子が引き寄せられます。そのため、Oの酸化数は-2、Cの酸化数は+4になります。
しかし、あくまで注意していただきたいのは、共有結合の物質では各原子はイオンの状態では存在していないということです。共有結合性物質の酸化数は酸化還元反応を把握するための便宜上の数字でしかありません。
酸化数を求める規則
実際には、電気陰性度で酸化数を求めるのは非常に手間なので、次の経験的な規則にもとづいて求めます。
- 単体中の原子の酸化数は0。
- 単原子のイオンの酸化数は電荷と同じ。
- 化合物中のHの酸化数は+1、Oの酸化数は-2。
- 電気的に中性な化合物の酸化数の総和は0。
- 多原子イオンでは、酸化数の総和が電荷と同じ。
- アルカリ金属の酸化数は+1、アルカリ土類金属の酸化数は+2。
しかし、この規則に当てはまらない例外も存在します。例外を下に書いておきました。
CaH2のHの酸化数
水素原子は電気陰性度が小さく、ふつうは電子を引っ張られてしまうので、酸化数は+1となります。しかし、CaH2ではCaの方が電気陰性度が小さいため、電子は水素に移り、Hの酸化数は-1となり、Caの酸化数は+2となります。
OF2のOの酸化数
FはOよりも電気陰性度が高いため、電子を引っ張ります。その結果、Fの酸化数が-1、Oの酸化数は+2となります。Fは電気陰性度が最大の物質のため、常に酸化数は-1です。
H2O2のOの酸化数
H2O2の構造式は次の通りです。
O-O間では電子の偏りが生じないため、O原子は隣接するH原子のみから電子をもらいます。そのため、Oの酸化数は-1、Hの酸化数は+1となります。
Fe3O4のFeの酸化数
Oの酸化数は-2であることを考えると、Feの酸化数をXとすると次の式で求められます。
3X + (-2) × 4 = 0
X= 8 / 3
酸化数は電子の授受を示す値ですから、整数でなければなりません。Feは二価と三価の陽イオンとなる原子ですから、次のように考えることができます。
+の酸化数は8、ーの酸化数も8で総和は0になります。
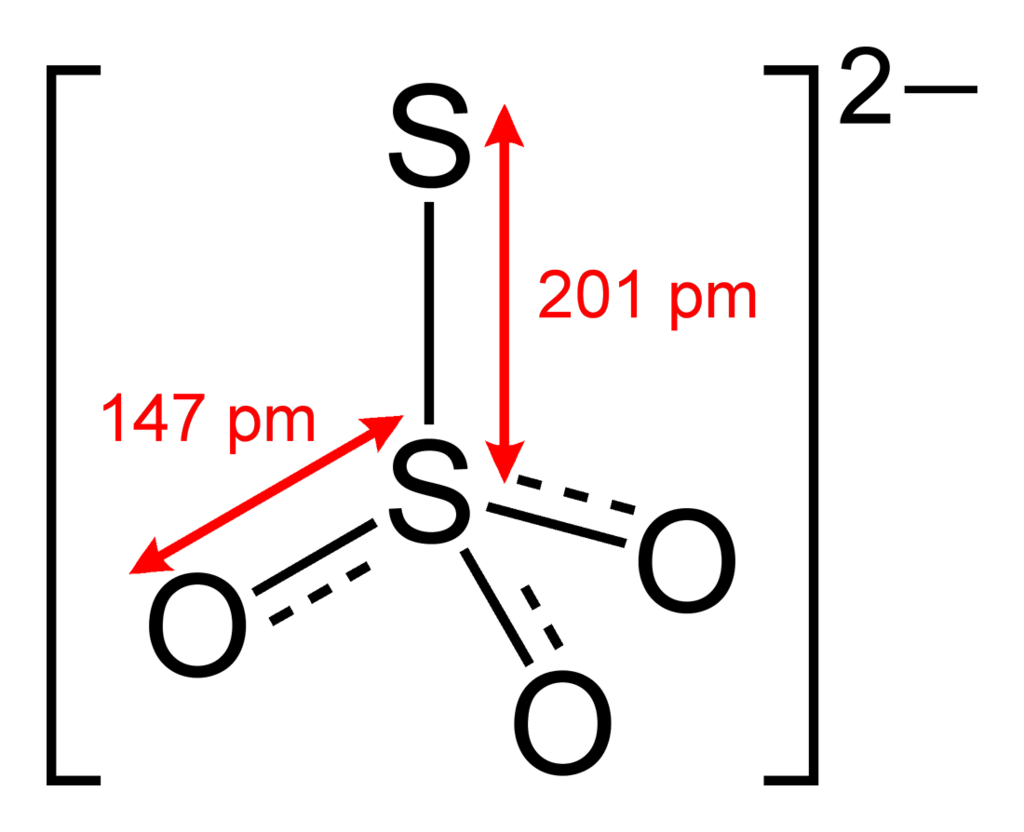
チオ硫酸イオンS2O32-のSの酸化数
チオ硫酸イオンS2O32-は、硫酸イオンSO42-のO原子の1つがS原子に置換された構造を持ちます。
O原子は酸化数は-2です。中央のS原子は、周囲のO原子から6個電子を引き抜かれており、電子が1つのみ残す状態です。S原子の本来の価電子は6ですから、電子が5つ足りません。そのため、中央のSの酸化数は+5です。一方、上側のS原子には価電子が7つあるため、酸化数は-1となります。
酸化数の変化と酸化還元
次の反応での酸化数を考えてみましょう。
2Cu + O2 → 2CuO
左辺ではそれぞれ酸化数は0ですが、右辺ではCuは+2、Oは-2と変化しています。このように酸化数が増加した時に「酸化された」、酸化数が減少した時に「還元された」と言います。
Mnの酸化数の変化を見てみると、+4から+2に減少しているためMn原子は還元されています。一方、Cl原子は左辺では-1です。右辺のMnCl2のCl原子の酸化数は-1ですが、Cl2のCl原子の酸化数は0です。4HClに含まれるCl原子2つが酸化されています。
酸化還元反応かどうかはどうやってわかるの?
構成原子の酸化数に変化があれば、それは酸化還元反応です。逆に変化がなければ、酸化還元反応ではないと言えます。
一般的に、単体(酸化数0)から化合物に、または化合物から単体(酸化数0)に変化している場合は、ほぼ酸化還元反応です。