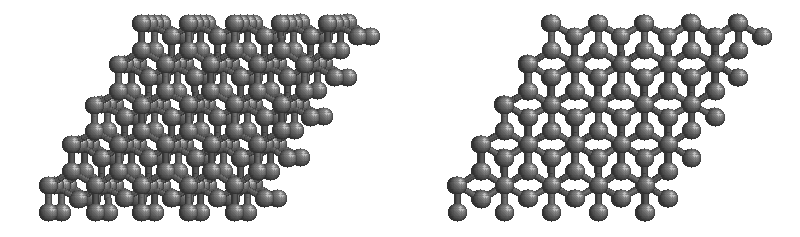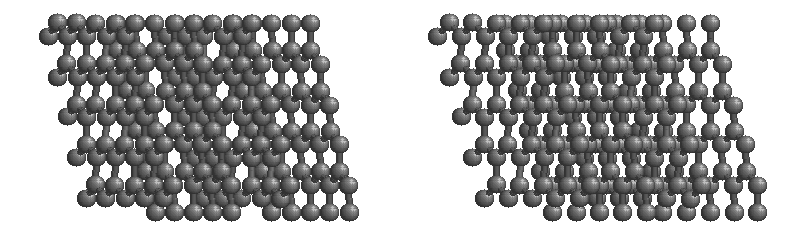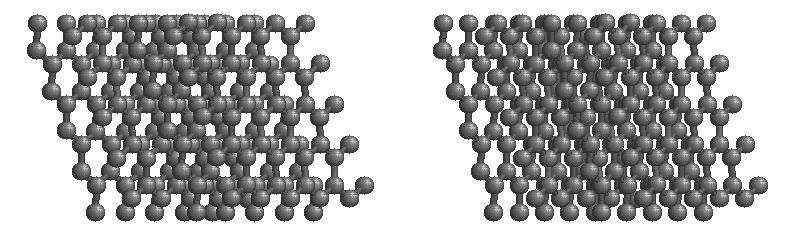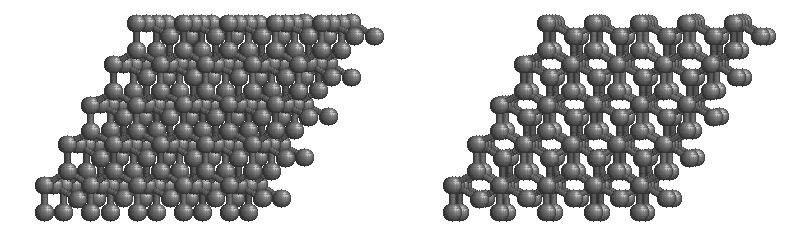共有結合の結晶とは
C、Si、Bなど、原子価を多く持つ原子は、多くの原子と共有結合を作り、巨大な結晶を作ることがあります。このように、全体が共有結合で結ばれた結晶を共有結合の結晶と呼びます。
共有結合の結晶の例としては、ダイヤモンド、黒鉛、ケイ素の単体Si、二酸化ケイ素(石英、水晶)SiO2、炭化ケイ素(カーボランダム)SiC(下画像)、窒化ホウ素NBなどがあります。

共有結合の性質
全ての原子が共有結合が結ばれているため、次のような性質を持ちます。
- 硬く、融点が極めて高い。
- 価電子が共有結合に使われているため、電気を通さない(例外:黒鉛)。
- 水や溶媒に溶けない。
- 共有結合には方向性があるため、結晶の密度はそれほど大きくない。
なぜ黒鉛は電気を通すの?
黒鉛は平面層が重なった構造を持つ物質です。この平面同士はファンデルワールス力で引きあっています。そのため、簡単に剥がれやすいのが特徴です。
黒鉛の各炭素原子は1個の電子が共有結合に使われずに残っています。この電子は、層状構造の上下にp軌道を持ち、軌道同士が重なっている部分を自由に移動します。そのため、平面と平行の方向に対しては電気を通す性質を持ちます。しかし、この平面の垂直の方向には、あまり電気を通しません(平面の平行の方向の1/1000)。