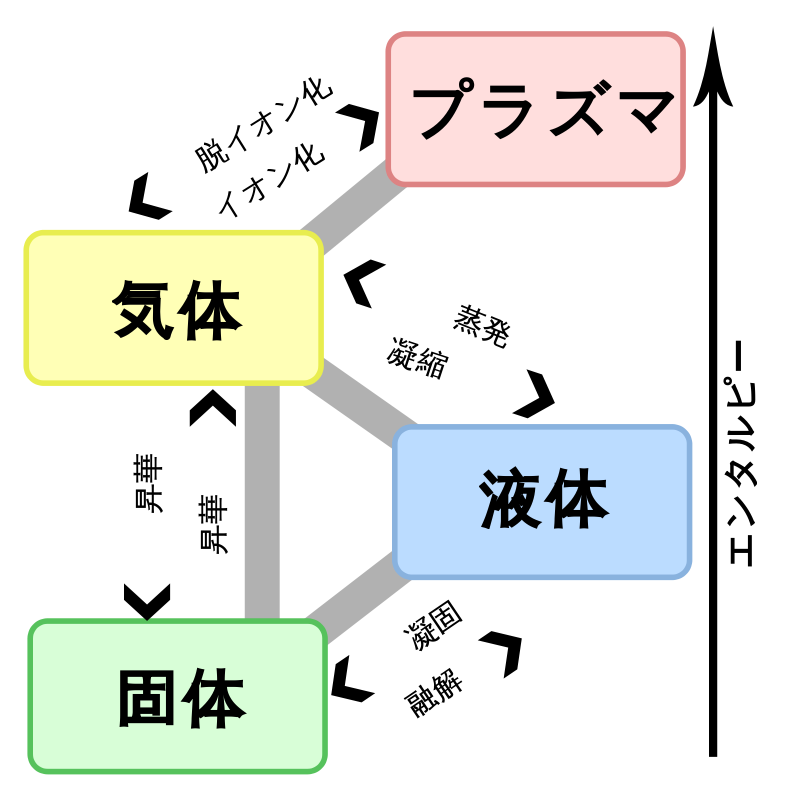
物質の三態とは?
物質は、固体、液体、気体のいずれかの状態をとることができます。これを物質の三態と呼びます(気体の中でイオン化したものをプラズマと呼びます)。
物質の状態変化は化学変化ではないため、温度・圧力などを元に戻すと、物質の状態は元通りになります。
物質の状態変化はどうして起こるの?
物質間に働く引力は、温度を大きくしても変化しません。しかし、物質自体の熱運動は温度が上がられば上がるほど激しくなるため、物質の状態変化が起こります。
ちなみに、熱運動は絶対零度になるまで停止することはなく、固体の状態であっても絶えず振動・回転が行われています。しかし、その粒子の位置は変わらないため、形は変化しません。
結晶・非晶質(アモルファス)の違い
多くの固体では、粒子が規則正しく並んだ結晶を形成します。しかし、粒子が不規則にならんだ固体を非晶質(アモルファス)または無定形固体と呼びます。アモルファスは一定の融点を持たず、ガラス、ゴム、プラスチックなどが例として挙げられます。
また、高分子の物体では、急激に冷却するとアモルファスを形成し、ゆっくり冷却すると結晶を形成します。金属でも同様の現象が見られます。
固体は液体になると体積が増加する
水を除いて、殆ど物質は固体から液体になると体積が10%ほど増加します。これは、液体になると粒子が運動するため、空いた空間ができ、その空いた空間に他の粒子が入り込む…というような運動を繰り返しています。そのため、瞬間的には空いた空間ができ、体積が大きくなります。
粒子間の引力に打ち勝つと気体になる
液体を加熱していくと、熱運動が激しくなり、粒子間の引力にとらわれなくなり、空間に飛び出します。液体から気体になると、体積は1000倍近くになります。粒子間に働くファンデルワールス力は0になります。
状態変化とエネルギー
エネルギーの状態は気体>液体>固体の順に高いです。それぞれの状態を変化を次のように呼びます。
- 固体→液体:融解
- 液体→固体:凝固
- 液体→気体:蒸発
- 気体→液体:凝縮
- 固体⇔気体:昇華
なぜ物質を融解している間は温度が上昇しないの?
氷が水になる温度を融点と呼びます。氷と水が共存している間は外部から温度を加えても一定です。これは、外部から加えられた熱エネルギーが、分子間の平均距離を大きくする位置エネルギーの増加のために使われるからです。状態変化が起こっている最中は、温度は変化しない、これは状態変化のセオリーです。
融点と凝固点
ある物質を冷却すると、凝固が始まります。この温度を凝固点と呼びます。純粋の物質の場合、融点=凝固点です。
融解熱と凝固熱
固体の物質1molが完全に液体になるまでに必要なエネルギーを融解熱と呼び、液体1molが完全に凝固するのに放出される熱エネルギーを凝固熱と呼びます。融解熱=凝固熱です。
凝縮と凝縮熱
気体1molが凝縮して液体になるときには、熱エネルギーが放出されます。これを凝縮熱と呼び、蒸発熱と等しい値です。
昇華と昇華熱
固体1molが気体になるときに必要な熱エネルギーを昇華熱と呼びます。昇華熱は次の式で求められます。
なぜ蒸発するの?
例えば、水が沸騰していなくとも蒸発していく現象はよく目にします。これは、液体の中に存在する分子の中には、非常に運動エネルギーが高い粒子も存在し、お互いの引力に打ち勝って空間へ飛び出していくためです。マクスウェル・ボルツマンの分布図では、どの温度の物質にも速度0m/sの粒子から、高い速度を持つ粒子が存在し、その平均によって「温度」が定められます。
蒸発熱とは?
物質が蒸発すると、その分エネルギーを持った粒子が抜けるわけですから、液体の温度は下がり始めます。液体1molの温度を一定に保つために必要なエネルギーを蒸発熱と呼びます。一般に、粒子間の引力が強い物質ほど、沸点が高く、蒸発熱も大きくなります。
なぜ融解熱より蒸発熱の方が大きいの?
一般に融解熱よりも蒸発熱の方が大きいです。これは、蒸発熱ではすべての粒子間の結合を切るエネルギーを要するためです。一方、融解熱では分子間で、粒子が動けるだけの距離を作り出すエネルギーさえあれば良いです。よって、蒸発熱の方が融解熱よりも大きくなります。
次のグラフが示す通り、融解熱と蒸発熱には大きな差があります。
| 融解熱(kJ/mol) | 蒸発熱(kJ/mol) | |
| N2 | 0.72 | 5.58 |
| HCl | 1.97 | 16.7 |
| NaCl | 28.2 | 171 |
| Fe | 15.1 | 354 |
トル―トンの規則とは?
多くの物質では、蒸発熱 / 沸点 ≒85J/K・molとなります。これをトルートンの規則と呼びます。これは、全ての物質に当てはまるわけではなく、沸点が高すぎず、低すぎない物質に当てはまる、あくまで経験則です。