イオン結合とは?
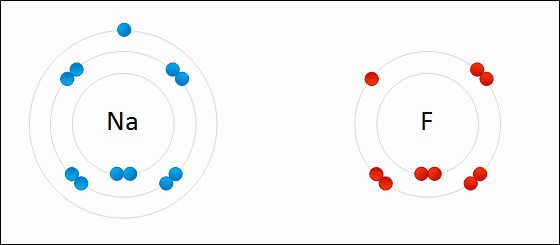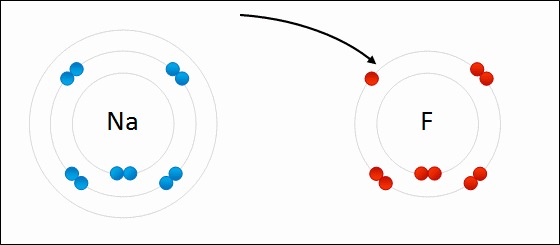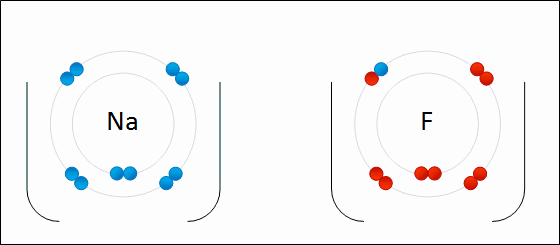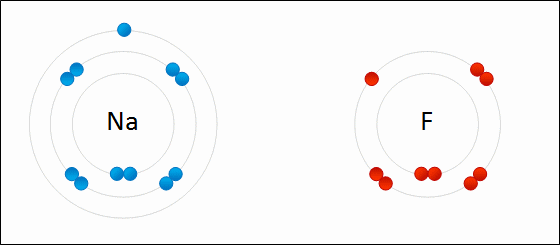
NaとCl2が出会うと激しく反応し、NaClを生成します。この時、Naは電子を放出してNa+となり、Clは電子を受け取りCl–となります。Na+とCl–は、お互いに静電気力(クーロン力)によって結びつきます。この結合をイオン結合と呼びます。
下のGIF画像はNaFが生成される様子です。
一般的に、周期表の左側にある元素が陽イオンになりやすく、右側にある元素(希ガスを除く)が陰イオンになりやすい性質を持ちます。
クーロンの法則とは?
クーロン力は、2つの電荷の積に比例し、その電荷間の距離の二乗に反比例します。これをクーロンの法則と呼びます。
つまり、イオン結合は陽イオン・陰イオンの価数の積が大きいほど強いです。また、両イオンの距離が小さいほど強くなります。しかし、近すぎると電子同士の反発が生じるため、NaClは2.82Åの距離で保たれています。
イオン結晶とは?
クーロン力は全方位に向かって及ぶので、NaCl1つだけでは安定しません。そのため、周囲にもNa+とCl–が集まり、エネルギーを安定させようとします。このようにできた規則正しく並んだイオンの集合体をイオン結晶と呼びます。
NaCl(イオン結合性物質)は気体になる?
イオン結合性物質も膨大なエネルギーを加えれば気体になります。NaClの沸点は1413℃ですが、沸点以上になると大部分がNaClという単独の分子(NaClの2つの原子のみ)と存在するようになります。中には二量体(NaClが2セット)で存在しているものもあります。
さらに加えるエネルギー量を上げれば、Na+(気)、Cl–(気)にすることも可能です。このイオン化した気体をプラズマと呼びますが、非常に不安定な状態です。
組成式とは?
イオン結晶には無数のイオンが含まれており、それを数で表すのは難しいです。そのため、イオンの種類とその割合を最も簡単な数で示した式で表します。これを組成式と呼びます。
例えば、NaとOのイオン結合の場合、Na+が2個、O2–が1個で電荷が釣り合うため、Na2Oという書き方をします。
陽イオンと陰イオンの電荷の数が同じになるため、次の式が成り立ちます。
イオン結合性物質の命名方法
命名法Ⅰ:酸に由来しない陰イオンの場合
イオン結合性物質は次のような命名法で名前が付けられています。
陰イオンは具体的には、塩化、酸化、硫化、窒化 、フッ化、シアン化(CN–)、水酸化(OH–)などがあります。例えば、F–とNa+の化合物であるNaFはフッ化ナトリウムと命名します。
命名法Ⅱ:酸に由来する陰イオンの場合
酸に由来する陰イオンには「化」はつけません。
例として硫酸ナトリウム、酢酸マグネシウムなどがあります。
価数が複数ある場合にはⅡやⅢをつける
Feのように価数が複数あるイオンを持つ化合物には、その元素の価数を(Ⅱ)や(Ⅲ)のように記します。
例:硫酸鉄 FeSO4(Ⅱ)、塩化鉄 FeCl3(Ⅲ)
イオン結合性物質の性質
①融点や沸点が高い
イオン結合では、クーロン力が大きいため、融点や沸点は高いものが多いです。
クーロンの法則により、イオンの価数が大きく、イオン半径が小さいほど、クーロン力が大きくなり、融点が高くなります。LiFはイオン間距離が2.07Å、MgOは2.05Åと、イオン間はほぼ同じ距離ですが、融点はLiFは870℃、MgOは2800℃と大きく異なります。MgOの方が価数の積の値が大きく、クーロン力がLiFよりも大きいためです。
②水に溶けやすい
イオン結合性物質の多くは水に溶けやすく電離します。しかし、AgCl、BaSO4、CaCO3のように水に溶けにくいものも存在します。
KClは水に溶けるのにAgClはなぜ水に溶けないの?
KClはそれぞれ電気陰性度の差が大きいので、水の中ではOH–とH+のイオンが寄ってきて電気的に中和された状態となり、電離します。
一方、AgClはそれぞれの電気陰性度の差がそこまで大きくないため、どちらかというと共有結合のような状態になっています。そのため、OH–やH+が上手く水和できず、「水に溶けない」という現象が起こります。
③固体は電気を通さないが液体は電気を通す
イオン結合性物質の固体は電気を通しません。これは、+-+-+-+-とイオンが規則正しく配列されており、全体が電気的に中和されている状態となっているためです。そのような中に電気(電子)を通そうとすると、すごい電圧が必要となります。
一方、イオン結合性物質の液体は電気を通します。これは、+-のイオンの自由に動いており(電気的に中和されておらず)、電子の受け渡しが可能な状態となっているためです。
また、水に溶かして溶液にすると、その水溶液は電気を通すようになります(蒸留水は電気を通さない)。これもイオンが自由に動けるためです。
④結晶は硬いがもろい
結晶は硬いですが、強い力を加えると割れてしまいます。これは、イオンの配列がずれると、陽・陰イオン同士の反発力が生じるためです。