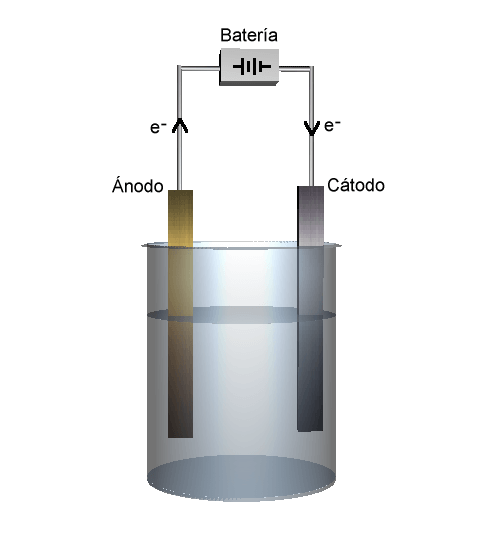
電気分解とは?
電気分解とは、電気エネルギーを使って酸化還元反応を起こすことを指します。電池とは真逆の反応です(電池は酸化還元反応を使って電気エネルギーを取り出す)。
陰極・陽極とは?
電気分解では、電源(電池)の負極に繋いだ電極を陰極、正極に繋いだ電極を陽極と呼びます。電気分解における電極では、化学反応しづらいことが求められ、Ptや黒鉛などが使われます。
正極・負極・陽極・陰極の違い
電池で電子が放出される電極を負極、電気を受け取る電極を正極と言います。電気分解で、電池の負極に繋いだ電極を陰極、正極に繋いだ電極を陽極と呼びます。
電池:負極 ===e-==⇒ 陰極
電池:正極 ===e-==⇒ 陽極
負極では酸化反応が起こりますが、陰極では還元反応が起こります。同様に、正極では還元反応が起こりますが、陽極では酸化反応が起こります。
陰極での反応
陰極では電子を受け取る反応(還元反応)が起こります。電子を受け取るのは陽イオンです。
イオン化傾向が低い金属イオンが還元されて単体として析出します。H+よりもイオン化傾向が高い金属イオン(K+、Na+、Mg2+、Al3+など)しかない場合には、水溶液の水分子が還元されてH2が発生します。
イオン化傾向が中程度の金属イオン(Zn2+、Fe2+、Ni2+)が存在する場合には、は水溶液中のH+が電子を受け取ってH2が発生します。しかし、H+の濃度はそこまで高くないため、それらの金属イオンも還元し、単体として析出します。H+の濃度が十分に高い(酸などが含まれている)場合には、H2の発生量が増えます。
また、金属が単体として析出するのに比べ、気体の発生にはいくらか余分にエネルギーがかかります。H+が還元されるだけではなく、H同士の結合、H2の離脱などのプロセスを経るため、余分な電圧(過電圧)を必要します。
陽極での反応
陽極では電子を奪われる反応(酸化反応)が起こります。構造が単純な単原子イオンから電子が奪われていきます。
ハロゲン化物イオン(F–、Cl–、Br–、I–)が存在していれば、それらが酸化されます。電気陰性度が小さなものほど、酸化やすいです(F– < Cl– < Br– < I–)。
次に、SO42-、NO3–、PO43-のように酸化されにくい多原子イオンが存在する場合には、水分子が酸化されます。
なぜSO42-、NO3–、PO43-は酸化されないの?
いずれのイオンも中心原子は最高酸化数をとっています。
| SO42- | +6 |
| NO3- | +5 |
| PO43- | +5 |
そのため、中心原子はこれ以上酸化することはできません。また、SO42-などでは、⊖に帯電していますが、負電荷が2個のO原子に局在化しています。しかし、実際には共鳴によって4個のO原子に非局在化して、安定しています。
濃硫酸を電気分解するとどうなるの?
SO42-は水溶液中では電子を放出しないですが、水がない状態(濃硫酸)ではHSO4–が電子を奪われて酸化し、ペルオキソ二硫酸になります。
陽極に酸化されやすい物質を用いた場合
上記の反応は陽極にPtなどを用いたことが前提となっています。もし、陽極にAg以上のイオン化傾向が高い金属を用いた場合には電極が溶けだして電子を放出します。
塩化銅(Ⅱ)水溶液の電気分解(電極Pt)
水溶液中にはCu2+、Cl–、H+、OH–のイオンが存在しています。電子の受け取りやすさは、Cu2+ > H+、電子の放出しやすさはCl– > OH–です。
陰極では次の還元反応が起こります。
陽極では次の酸化反応が起こります。
水酸化ナトリウム水溶液の電気分解(電極Pt)
水溶液中には、Na+、H+、OH–のイオンが存在しています。Na+は電子を受け取らないため、陰極では次の還元反応が起こります。
しかし、実際には溶液中にはH+は殆ど存在しないため、水が以下のような反応式で還元されていると考えられています。
陽極では次の酸化反応が起こります
塩化ナトリウム水溶液の電気分解(電極Pt)
水溶液にはNa+、Cl–、H+、OH–のイオンがあります。陰極では次の反応が起こり、水溶液はアルカリ性になります。
一方、陽極では次の反応が起こります。
硫酸銅(Ⅱ)水溶液の電気分解(電極Pt)
水溶液にはCu2+、SO42-、H+、OH–のイオンがあります。陰極では次の反応が起こります。
陽極では次の反応が起こります。
OH-が酸化されないのはなぜ?
CuSO4は弱酸性(強酸と弱塩基の塩)ですから、水溶液中にはOH–は僅かしか存在しません。そのため、次の反応は殆ど起こりません。