滴定曲線とは?
中和滴定において、加えた酸・塩基の体積と、pHの関係を示したグラフを滴定曲線と呼びます。滴定曲線では、少しずつ中和され、中和点に近づくと急激にpHが変化します。これをpHjump(pH飛躍)と呼びます。
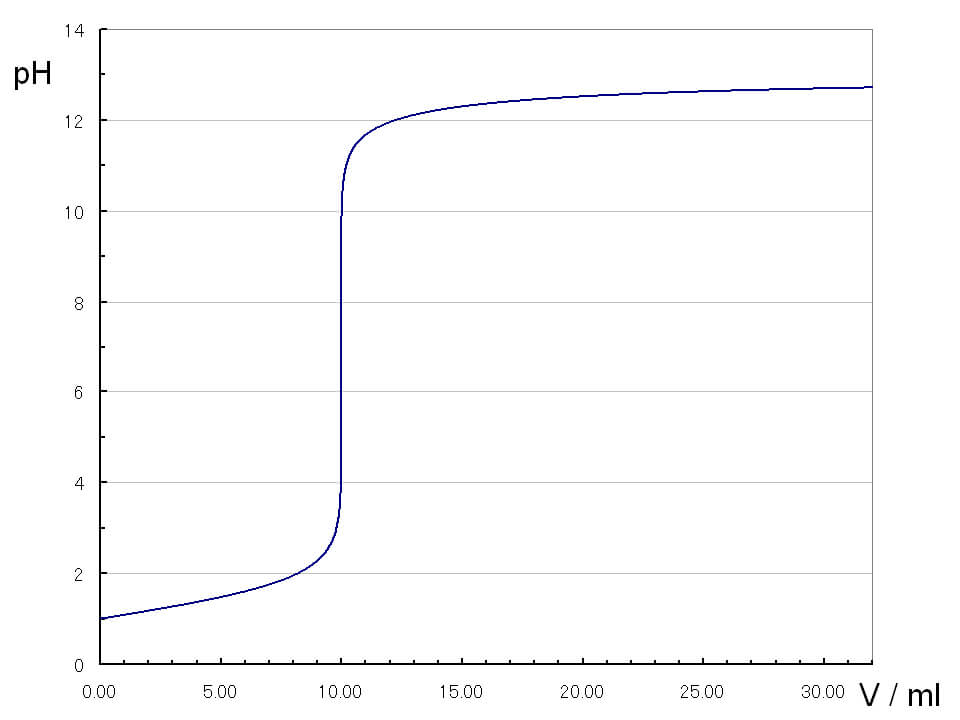
pHjumpの中心が中和点
一般的に、強酸と強塩基の滴定曲線では、広範囲にpHjumpが見られます。また広範囲のpHjumpの中心が、その滴定の中和点となります。
なぜpHjumpが起こるの?
pH1がpH2に変化した場合にはH+の濃度は次のようになります。
つまり、濃度が1/10になります。また、pH5からpH6への変化においても濃度が1/10になります。
濃度が1/10に変化するという点では両者は一致していますが、変化に要する物質量には大きな差があります。
例えば、1mol/1のH+が1l存在した場合、pH1からpH2へ変化するには次の量の変化が必要です。
しかし、pH5からpH6への変化へは次の量の変化が必要です。
pH1からpH2へ変化させるためには、OH–は0.9mol必要ですが、pH5からpH6への変化するのには、OH-は僅か0.000009molしか必要ありません。pH1からpH2へは中々変化しませんが、pH5からpH6へはジャンプしてしまうのは、このためです。
酸・塩基の強弱と滴定曲線
強酸と強塩基の滴定曲線
強酸と強塩基の滴定曲線は、pHjumpの領域がほぼ垂直となるため、pHjumpの領域内で変色する指示薬を使用することができます。実際には、変色が見やすいことからフェノールフタレイが使用されます。
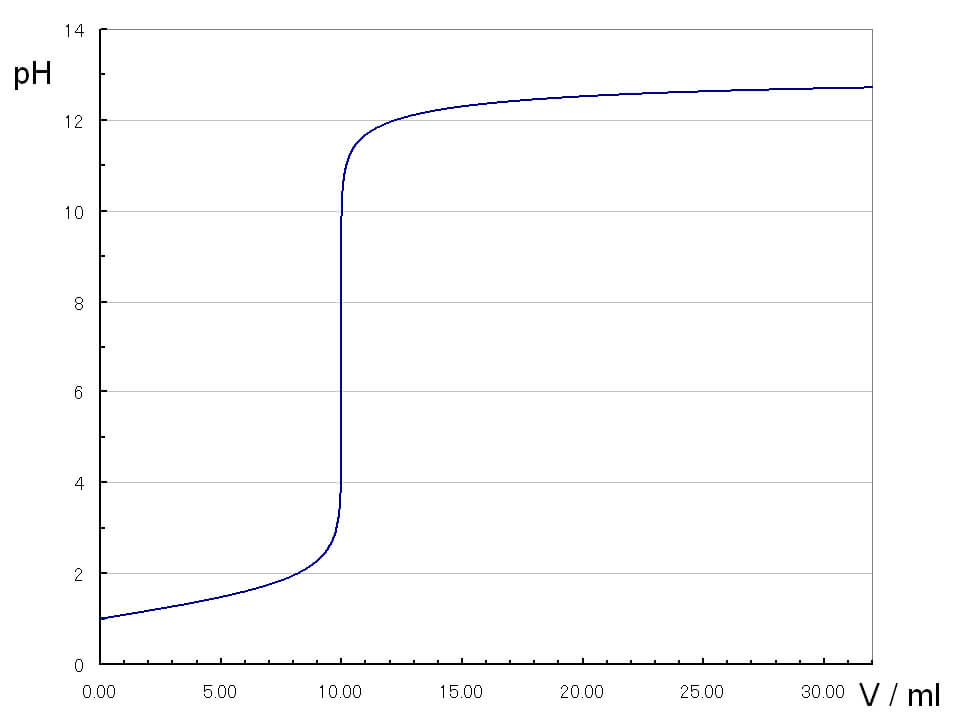
弱酸と強塩基の滴定曲線
弱酸は電離度が低いため、滴定開始時のpHが高いです。NaOHを加えていくと、最初のpH変化は強酸と強塩基の滴定の時よりも大きく動きます。その後、pHjumpが生じます。pHjumpは強酸・強塩基の滴定曲線の時よりも幅が小さいです。
なぜ始めのpH変化が大きいの?
CH3COOHとNaOHは中和反応をします。
CH3COONaは次のように完全に電離しています。
CH3COOHは、弱酸であるためそもそも電離する力が弱いです。そこにさらにCH3COO–が大量にあることにより、共通イオン効果によってCH3COOHの電離が抑制されます。その結果、H+の量が少ない状態となり、NaOHを始めに僅かに加えただけでpHが思った以上に上昇します。
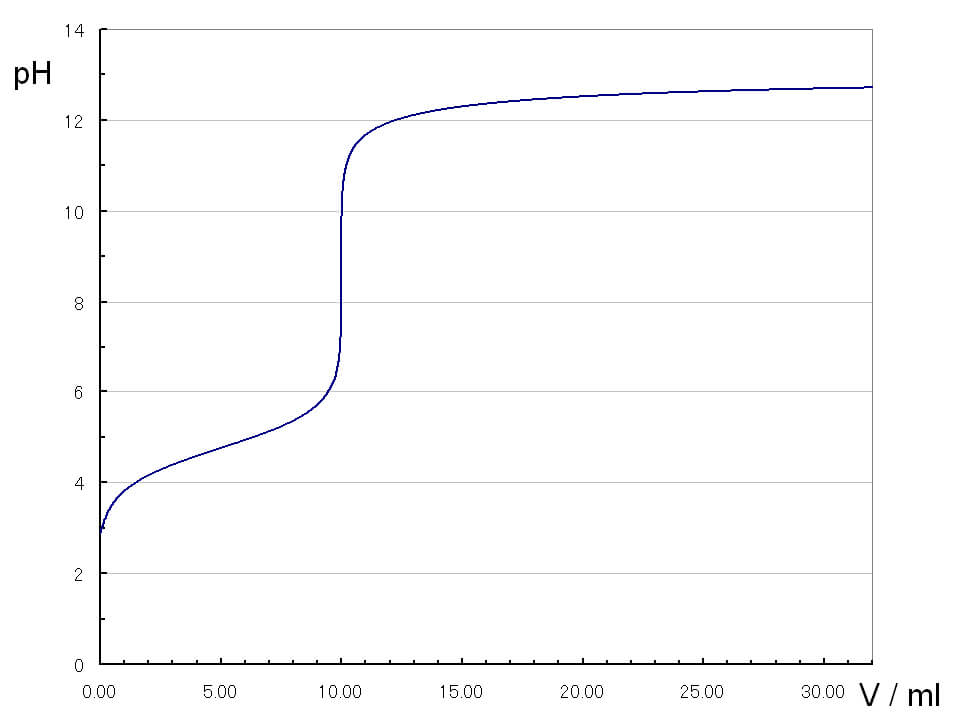
強酸HClと弱塩基NH3の滴定曲線
pHjumpの領域は、狭く、酸性側に偏っています。これは、生じたNH4Clが加水分解をして弱酸性を示すためです。塩基性側に変色域を持つフェノールフタレインは使えず、メチルオレンジを指示薬に使います。
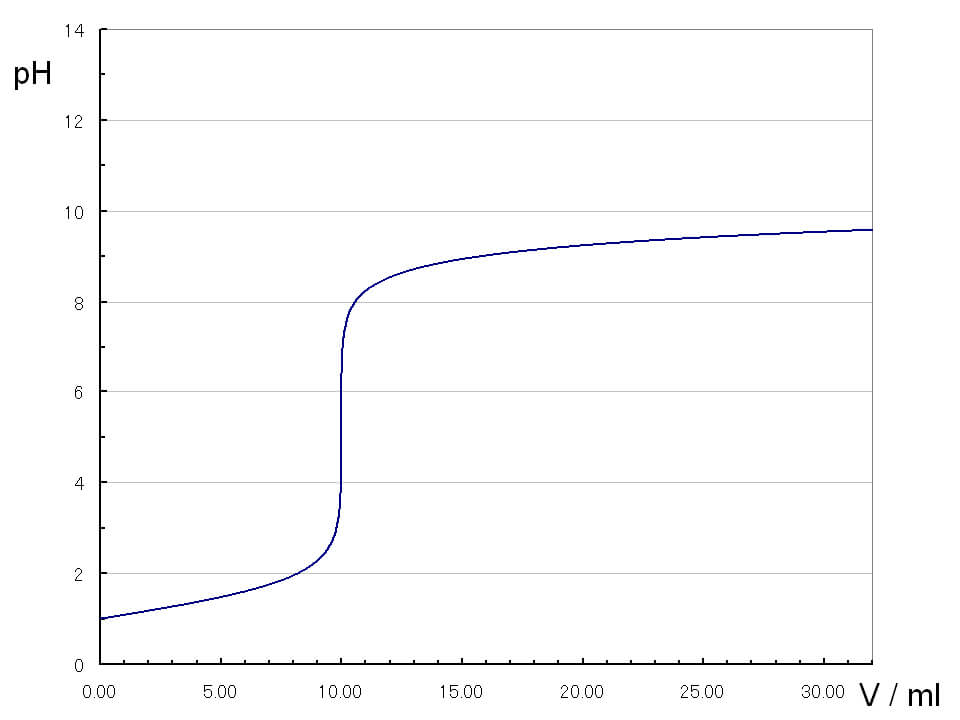
弱酸CH3COOHと弱塩基NH3の滴定曲線
pHは徐々に上昇し、pHjumpは殆ど見られません。またその幅も狭いため、指示薬を使って測定することは不可能です。電気伝導性の測定で中和点を測定します。
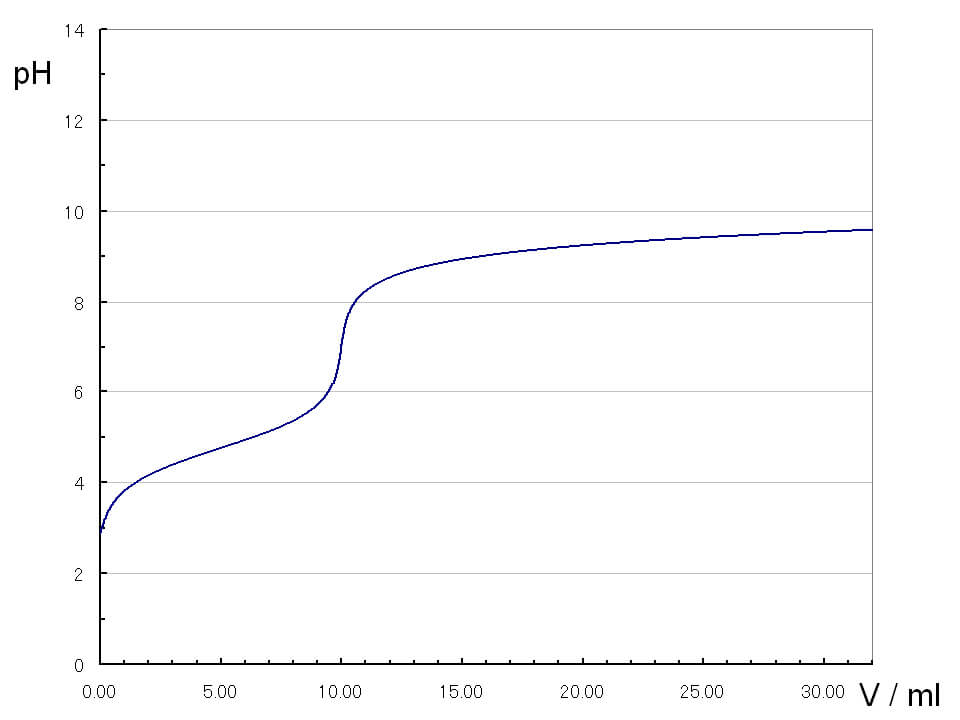
多段階の滴定曲線
炭酸の滴定では、2段階の滴定曲線が表れます。始めの中和点ではNaHCO3が生じ、2番目の中和点ではNa2CO3が生じます。1番目の中和点を第1中和点、2番目の中和点を第2中和点と呼びます。
炭酸の第2中和点は強塩基性pH12付近にあるため、指示薬では見つけることはできません。
硫酸・シュウ酸の滴定曲線
硫酸やシュウ酸のように第1電離と第2電離の差がそこまで大きくない酸では、第1電離の中和が完了しないうちに第2電離の中和が並行して行われます。そのため、pHが徐々に上昇し、第1中和点ははっきりせず、第2中和点のみがはっきり現れます。
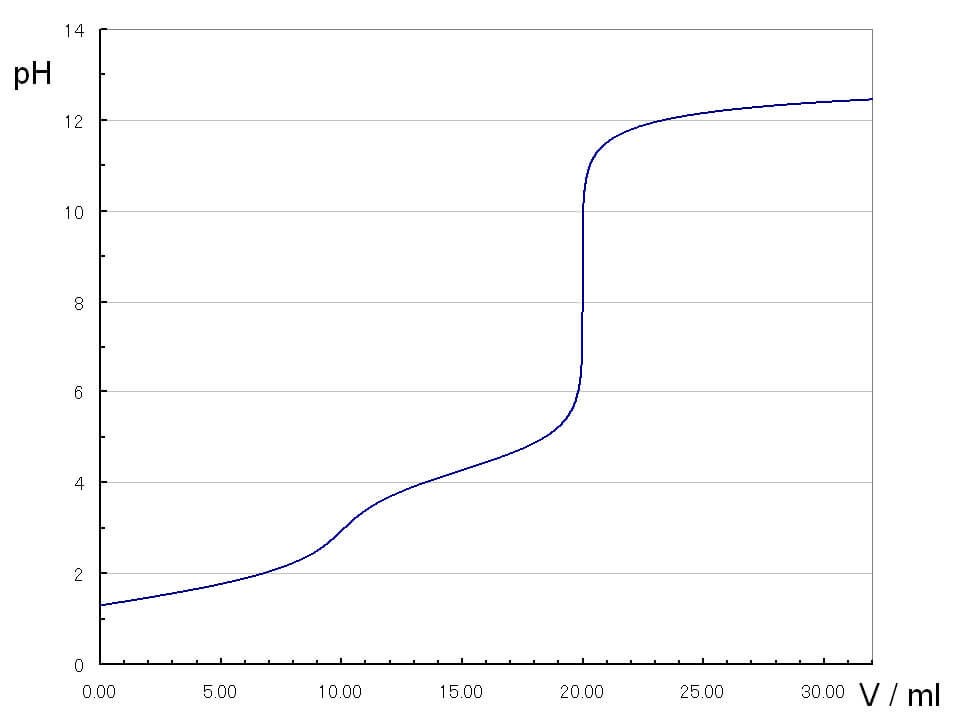
リン酸の滴定曲線
リン酸では、第1中和点、第2中和点、第3中和点が見られます。第1中和点は酸性寄りにあるため、メチルオレンジを指示薬に使い、第2中和点ではフェノールフタレインを使います。第3中和点は、強塩基性の領域にあるため指示薬は使えません。
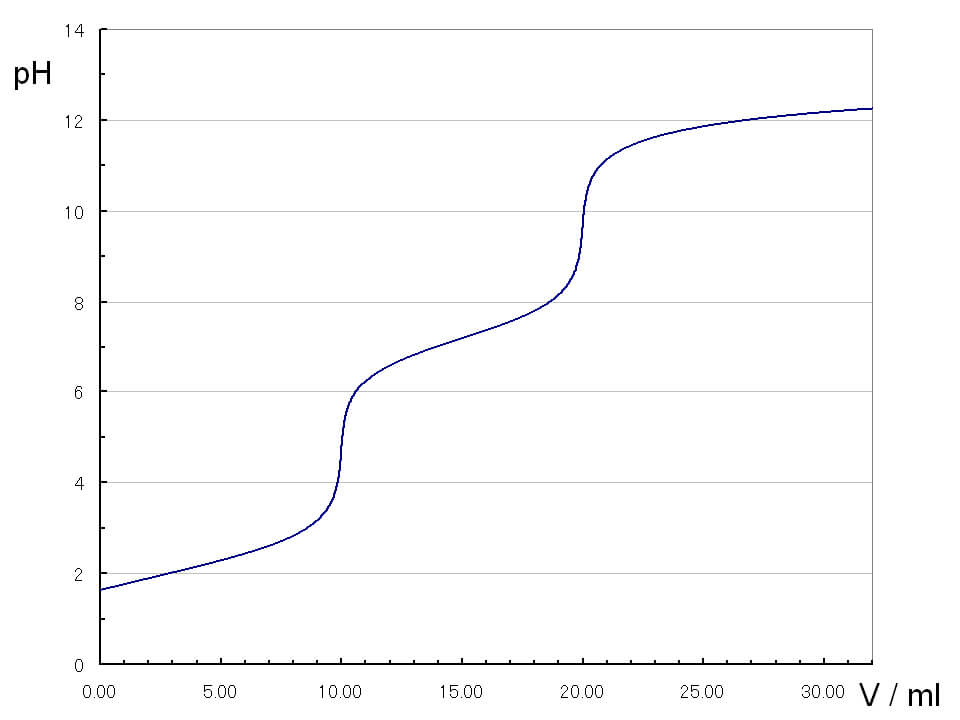
混合塩基の定量:ワルダー法
NaOHとNa2CO3の混合水溶液にフェノールフタレインを加えて、HClの標準溶液で滴定していくと、滴定曲線が得られます。滴定曲線では、第1中和点、第2中和点が出現します。
第1中和点では、次の反応が起こります。
NaOH + HCl → NaCl + H2O
Na2CO3 + HCl → NaHCO3 + NaCl
この中和点はフェノールフタレインの赤色の消失で知ることができます。
さらに滴定を進めると、第2中和点では次の反応が起こります。
この中和点はメチルオレンジが赤色に変色することによって知ることができます。第1中和点から第2中和点までに加えたHClの量から、NaHCO3の物質量を知ることができます。
またNaHCO3の物質量が分かれば次の式により、Na2CO3の物質量も計算することが可能となります(NaHCO3とNa2CO3の物質量は同じ)。
混合塩基の定量:ウィンクラー法
ウィンクラー法で操作1と操作2によって混合水溶液の各溶質の濃度を求めます。
操作1
NaOHとNa2CO3の混合水溶液を三角フラスコに等分し、一方にはメチルオレンジを加えて黄色に呈色させます。そこに、HCl標準溶液で滴定すると、中和点に達するまでに以下の反応が起こります。
NaOH + HCl → NaCl + H2O
Na2CO3 + 2HCl → NaCl + H2O +CO2
メチルオレンジの変色は第2中和点を指すため、NaOHとNa2CO3は全て中和されたことを示します。つまり、NaOHとNa2CO3の総量としての物質量が得られます。
操作2
また、一方の三角フラスコには白色沈殿が生じなくなるまで塩化バリウムBaCl2水溶液を加えます。
これにより、Na2CO3は取り除かれてNaOHだけが残ります。このNaOHを塩酸の標準溶液で中和滴定を行い、フェノールフタレインを指示薬として中和させます。これにより、NaOHの物質量が求められます。
計算する
操作2でNaOHの物質量が分かることにより、操作1で得た物質量からNa2CO3の物質量を求めることができます。
