分子間に働く力とは?
分子間に働く力には、極性引力、ファンデルワールス力、水素結合などがあります。
極性引力とは?
極性を持つ物質には、お互いに引きあう力(+と-の静電気力)が生じる。これを極性引力と呼びます。
ファンデルワールス力とは?
どの原子も陽子の周りに電子が運動しており、十分な時間を置けば電子は平均的に分布していますが、その一瞬一瞬では、電子の位置によって電荷の偏りが生まれています。
分子Aがある瞬間分極したとすると、その隣にいた分子Bも分極させられ、僅かにAとBの間に引力が生じます。この時に生じる僅かな引力をファンデルワールス力と呼びます。
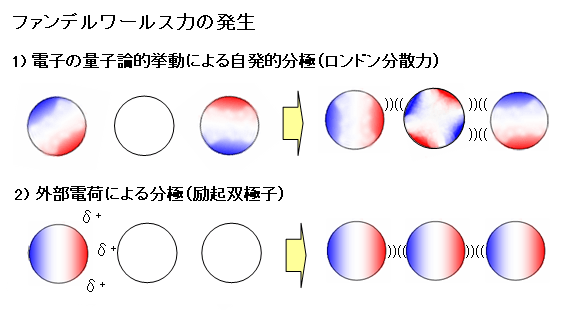
分子が大きくなるほどファンデルワールス力も大きくなる
ファンデルワールス力は瞬間的な電荷の偏りを生じさせることができる電子の数が多いほど、強くなると考えられています。そのため、分子量が多くなればなるほど、ファンデルワールス力も大きくなります。
ファンデルワールス力が大きくなるということは、融点・沸点が高くなるということでもあります。そのため、構造がよく似た物質は、分子量が大きいほど融点・沸点が高いという性質を持ちます。
ファンデルワールス力は極めて近い時にしか働かない
ファンデルワールス力は分子同士が極めて近い時には発生しますが(固体や液体)、気体では殆ど発生しません。また、分子間距離の範囲内では、その力の大きさは、6乗に反比例します。つまり、分子間の距離が2倍になると、ファンデルワールス力は1/64になるということです。
水素結合とは?
F、O、Nなどの電気陰性度が大きな原子との水素化合物は、大きな極性が生じ、分子間で静電気力に基づく弱い結合が形成されます。これを水素結合と呼びます。
電気陰性度の大きな原子と結合している水素は、実質、水素の電子を殆ど取られ、原子核(プロトンH+)に近い状態になっています。また、H+は内殻電子を持たないため、他の原子に十分に接近することができ、ある程度の強さの結合を結ぶことができます。
また、十分に分極した水素原子は、負に帯電している分子に接近した場合、非共有電子対をH+の軌道に受け入れ、水素原子が相手側に受け取られる現象が起こります。しかし、すぐにまた元の位置に戻り、この水素原子の受け渡しが絶えず行われます。これが水素結合の本質であると考えられています。
なぜHClは水素結合を作らないの?
HClは極性分子ですが、水素結合を形成しないことで知られています。これは、Cl原子の原子半径が大きいため、表面の負の電荷密度が小さく、Hδ+との間で強い引き合う力(静電気力)が生じないためだと考えられています。
海の青さと水素結合
厚い水の層(海や池)などを見ると、青色に見えます。これはよく空の色が映っているためと誤解されますが、本当は水分子が水素結合をしている水分子を押したり引っ張ったりする際に、赤色の光が僅かに吸収されるためです。
共有結合・水素結合・ファンデルワールス力の強さの比較
共有結合は、水素結合の強さの10~20倍程度であると考えられています。また、水素結合はファンデルワールス力の10倍の力を持ちます。
