タンパク質はアミノ酸が繋がったもの
タンパク質は20種類のアミノ酸が組み合わさってできている。アミノ酸は炭素原子にアミノ基(-NH2)とカルボキシル基(-COOH)が結合した物質である。また、炭素原子には水素原子と側鎖(Rと呼ぶ)が結合している。側鎖の違いがアミノ酸の種類を決定している。
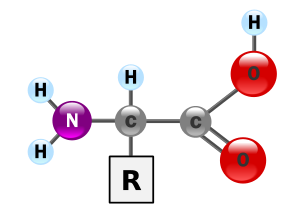
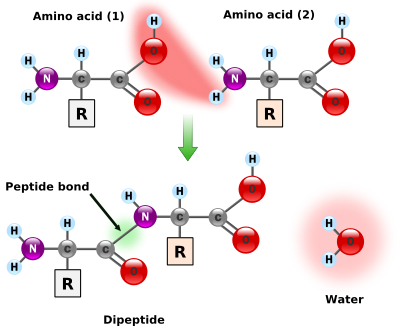
アミノ酸同士はペプチド結合で繋がる
アミノ基からHが、カルボキシル基からOHが取れてH2Oを形成し、アミノ基とカルボキシル基は結合する。この結合をペプチド結合と呼ぶ。
タンパク質の立体構造をもっている
一次構造
アミノ酸の種類と配列順序のこと。2分子以上をペプチド、多数結合した高分子化合物をポリペプチドと呼ぶ。
二次構造
水素結合によってα-ヘリックス、βシートなどの構造を形成したタンパク質のこと。側鎖のSH基の間で水分子がとれてS-S結合(ジスルフィド結合)を形成することもある。下画像はα-ヘリックスである。
三次構造
2次構造などによって3次元的に折りたたまれたタンパク質のこと。pHや温度などによって決まる。
四次構造
3次構造を持ったタンパク質が複数組み合わさってできたタンパク質のこと。下画像のヘモグロビンは4つのタンパク質が組み合わせってできている。
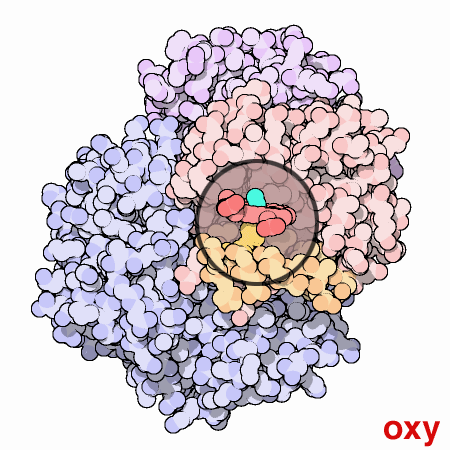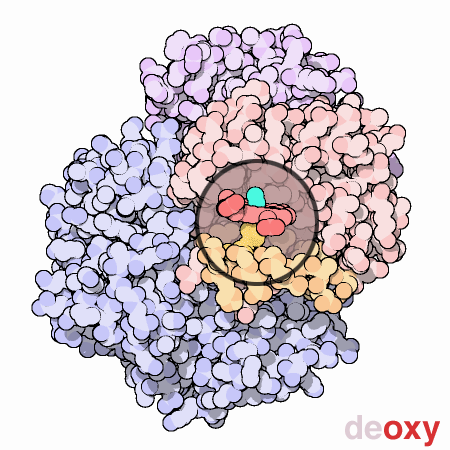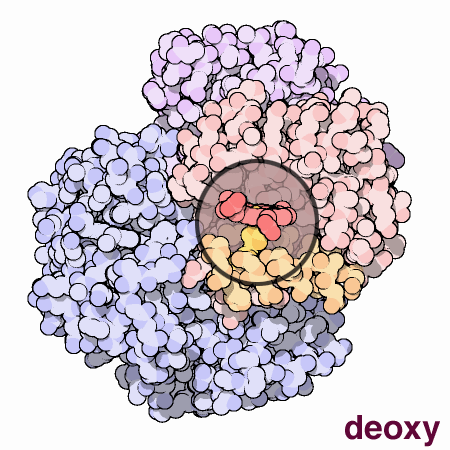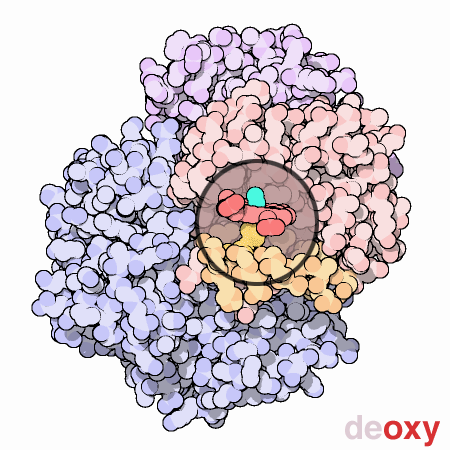
© 日本蛋白質構造データバンク (PDBj) licensed under CC 表示 4.0 国際
タンパク質の変性
タンパク質は熱・酸・アルカリに弱く、すぐに立体構造が壊れてしまう。このことを変性と呼び、タンパク質の機能を失うことを失活と呼ぶ。高次構造は壊れやすいが、タンパク質の一次構造は壊れにくい。
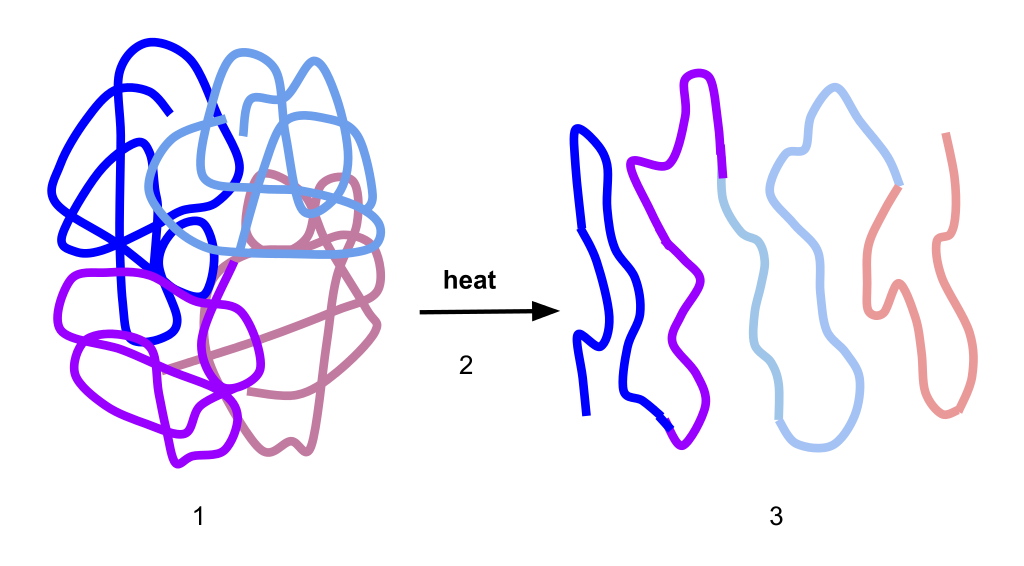
タンパク質を構成するアミノ酸と特徴
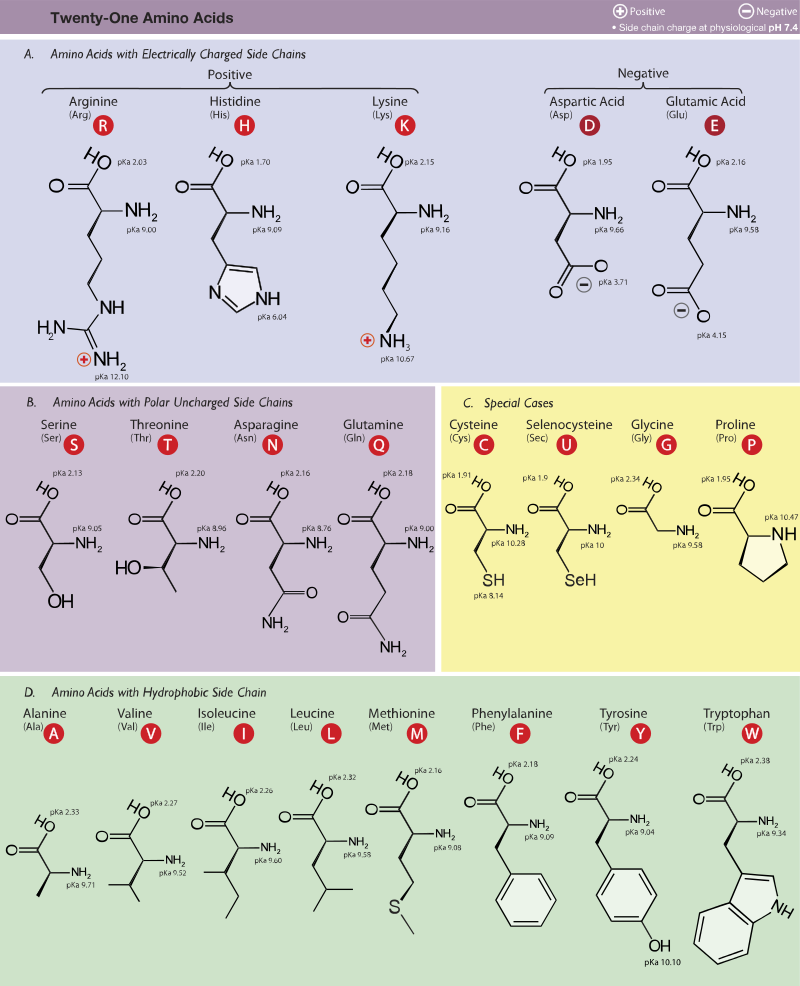
特徴的なアミノ酸
グリシン
側鎖がH原子だけであり、最も単純なアミノ酸である。
プロリン
システインとメチオニン
どちらも硫黄(S)を含むアミノ酸である。システインはS-S結合を形成するために重要な働きをする。システインはヒトでは必須アミノ酸ではなくメチオニンから生合成される。
酸性アミノ酸:アスパラギン酸 / グルタミン酸
側鎖中にカルボキシ基を含んでいるため、溶液は酸性となる。細胞中では負の電荷を帯びやすい。
塩基性アミノ酸:ヒスチジン / リシン / アルギニン
側鎖中にアミノ基を含んでいるため、溶液は塩基性となる。細胞中では生の電荷を帯びやすい。
なぜシステインだけS-S結合をするのか
メチオニンのSに隣接するのは炭素原子であり、その炭素原子に結合する水素原子も酸性度が高いわけでもなく安定で反応性には乏しい。
一方、システインはSに直接水素原子は結合しており脱離しやすく、ジスルフィド結合を形成できる。