酵素の基質特異性
酵素には基質と結合する活性部位がある。この活性部位と結合できる物質のみに作用する。この性質を基質特異性と呼ぶ。
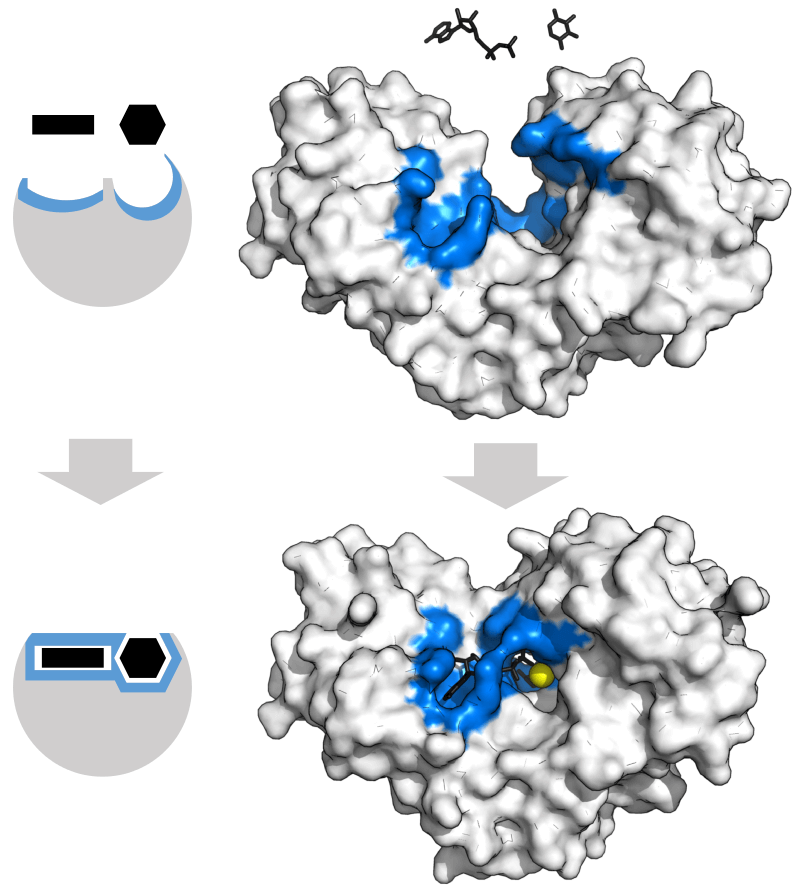
酵素の反応
酵素と基質が結合したものを酵素-基質複合体と呼ぶ。結合すると、酵素の構造が変化し、基質の活性化エネルギーを下げる。すると、基質が変化しやすくなる。このように活性化エネルギーを下げる働きをする物質を触媒と呼ぶ。
酵素と最適温度
酵素には反応速度が最大となる最適温度がある。温度が低すぎても反応しないし、高過ぎるとタンパク質構造が壊れてしまう。しかし、超好熱菌などの酵素の最適温度は100℃を超える。
酵素と最適pH
酵素には反応速度が最大となる最適pHがある。普通、pH6~pH8の範囲であるが、中にはペプシンのように強酸に強いものもある。
反応速度と酵素濃度・基質濃度
酵素濃度が高くなると反応速度は上がる。また、基質濃度が高くなると反応速度も上がる。
しかし、基質濃度だけをある程度まで高くすると、反応速度は上昇しなくなる。これは、酵素が基質と結合して離れるまで時間がかかるためである。そのため、反応速度は基質濃度が十分な場合は、酵素濃度に由来する。
競争的阻害
基質と化学的に構造の似た物質が活性部位を奪い合うために反応速度が下がる。基質濃度を十分にすれば反応速度はもとに戻る。
非競争的阻害
阻害物質が活性部位以外の部分に結合して酵素の構造を変化させる。基質濃度を高くしても反応速度は戻らない。
競争的阻害と非競争的阻害の違い
競争的阻害では、基質濃度に似た物質が混ざるために起こる反応速度の低下である(活性部位の奪い合い)。しかし、非競争的阻害は阻害物質が活性部位ではないところに結合して、酵素の構造を変化させ、反応速度を低下させる。
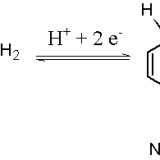
[…] 酵素の反応 […]