イオン結晶とは?
粒子が規則正しく並んだ構造を結晶と呼び、イオン結合による結晶はイオン結晶と呼びます。結晶内で粒子の空間配列の状態を表したものを結晶格子と呼び、その中で繰り返される最小単位の格子を単位格子と呼びます。
イオン結晶の単位格子には、塩化ナトリウム型構造、塩化セシウム型構造、硫化亜鉛型構造などがあります。
単位格子の違いはどのようにして決まるの?
イオン結合は、静電気力による結合であるため、決まった方向性を持ちません。そのため、陽イオンと陰イオンの半径の比で、格子のパターンが決定します。例えば一族の陽イオンと17族の陰イオンでは、塩化ナトリウム型構造の結晶格子となります。
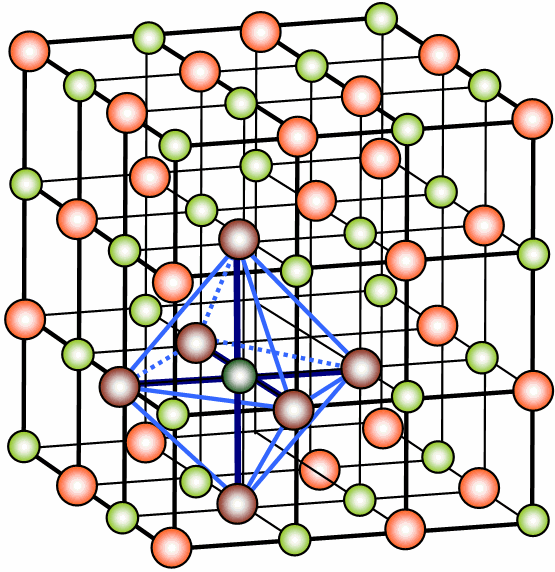
塩化ナトリウム型構造とは?
塩化ナトリウム結晶の単位格子の中心にあるNa+には、その周りに6個のCl–が取り囲んでいます。この1つの粒子に接する粒子の数を配位数と呼びます。NaCl結晶では、各イオンの配位数は6となっています。
塩化セシウム型構造とは?
塩化セシウム結晶の単位格子の中心にあるCs+は、その周りに8個のCl–が取り囲んでいます。Cl–も8個のCs+に取り囲まれており、配位数は8となっています。
なぜ塩化セシウム型格子の方が配位数が多いの?
Cs+の半径は1.7Åであり、Na+は0.97Åです。Cs+の方が大きなイオンのため、Cl–はよりたくさん取り囲むことができます。そのため、NaClは配位数は6ですが、CsClは配位数が8となっています。
逆に、陰イオンの半径が大きくなると、陰イオンが陽イオンを取り囲める数も少なくなります。
硫化亜鉛型構造とは?
ZnSの結晶では、各イオンの配位数は4となっています。
各単位格子の違いまとめ
それぞれの構造の単位格子の違いをまとめると次のようになります。
NaClの単位格子
| Na+ | 4個 |
| Cl– | 4個 |
| 配位数 | Na+:6、Cl–:6 |
CsClの単位格子
| Cs+ | 1個 |
| Cl– | 1個 |
| 配位数 | Cs+:8、Cl–:8 |
ZnSの単位格子
| Zn2+ | 4個 |
| S2- | 4個 |
| 配位数 | Zn2+ :4、S2-:4 |
限界半経比とは?
陽イオンと陰イオンが接した状態で、陽イオンの半径を小さくすると、ある所で陰イオン同士が接触し、それ以上単位格子の一辺の長さが変化しなくなります。この陽イオンと陰イオンの半径比を限界半経比といいます。
相転移とは?
CsCl型の結晶は469℃以上になると、NaCl型へと変化することが知られています。これは、高温になると熱運動により1つのCl-の占有する空間が広がり、配位数が少ない方が安定するためです。また、高圧にすると、より配位数が高い構造(高密度の構造)へと変化します。温度・圧力によって結晶構造が変化することを相転移と呼びます。