鉛蓄電池とは?
放電して起電力の低下した電池に電流を流すと、放電とは逆の反応が起こります。これを充電と呼びます。充電できる電池では鉛蓄電池が有名です。
一次電池と二次電池
逆向きの電流を流して充電ができない電池を一次電池、充電が可能な電池を二次電池または蓄電池と呼びます。
なぜボルタ電池は充電できないの?
ボルタ電池では正極で発生した水素は空気中に逃げています。また、負極で発生したZn2+は錯イオンに変化しているため、逆反応を起こす物質が存在しません。そのため、電流を逆流させても逆反応を起こすことができません。
なぜダニエル電池は充電できないの?
ダニエル電池を充電しようとすると、次の反応が起こります。
負極:Zn2+ + 2e– → Zn
正極:Cu → Cu2+ + 2e–
負極ではZnSO4だけならば問題なく反応が進みますが、H2SO4が加えられているとH2が発生してしまいます(ZnSO4の濃度が高いと電離が起こりづらいため濃度を下げ、また電気が通りやすいようにH2SO4を加えます)。また、ZnSO4とCuSO4が素焼き板を通って混合してしまいます。そのため、ダニエル電池は完全な二次電池ではありません。
鉛蓄電池の仕組み
鉛蓄電池の放電
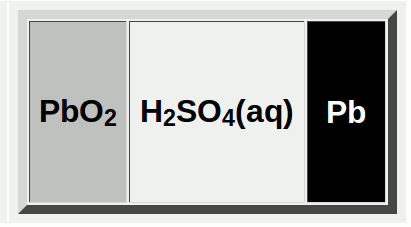
鉛蓄電池は次の電池式です。
⊖ Pb | H2SO4aq | PbO2 ⊕
法伝寺、負極ではPbが酸化してPb2+になります。その後、SO42-と結合し、PbSO4となります。
正極ではPbO2(酸化剤)が電子を受け取って還元され、PbSO4になります。
つまり、両極ともでPbSO4が発生します。また、正極では水が生成されるため、硫酸の濃度は徐々に低くなっていきます。
鉛蓄電池の充電
外部電源の⊖端子を負極に、⊕端子を正極に接続して電流を流すと逆反応が起こり、充電することができます。
PbSO4 + 2e– → Pb + SO42-
PbSO4 + 2H2O → PbO2 + 4H+ + SO42- + 2e–
正極・負極での反応式をまとめると次のようになります。右側への反応が放電、左側への反応が充電となります。
Pb + PbO2 + 2H2SO4 ⇔ 2PbSO4 + 2H2O
鉛蓄電池の分極
両極でPbSO4が生じると、反応できる電極の面積が小さくなります。また、水が生じることで硫酸の濃度が薄まります。結果、分極します。しかし、PbSO4が不溶で電極に付着しているために、充電することが可能となっています。