ダニエル電池とは?
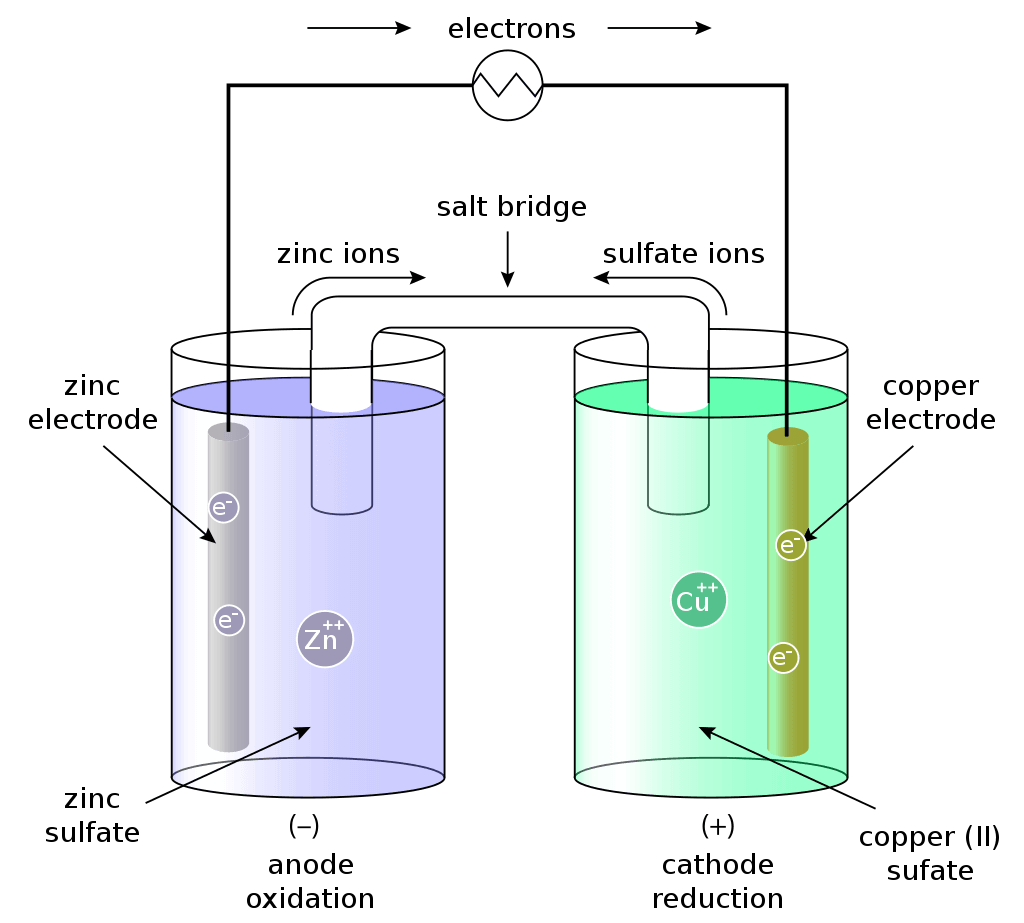
亜鉛板を硫酸亜鉛水溶液に浸し、銅板を硫酸銅(Ⅱ)水溶液に浸し、それぞれを素焼き板で仕切ったでんちをダニエル電池と呼びます。
亜鉛が負極となり、原子がイオン化します。
亜鉛板に溜まった電子は電位が高い銅板に流れ込みます。銅板の表面ではCu2+(硫酸銅水溶液由来)が電子を受け取り、Cuとして析出します。
ボルタ電池と比べてダニエル電池が優れている点とは?
ダニエル電池はボルタ電池とは違い水素が発生しないため、分極が起こらず、電圧が低下しません。
上の式で得られる反応熱212kJ/molを電気エネルギーとして取り出した形となります。
素焼き板の役割とは?
素焼き板はZnSo4とCuSO4の混合を防いでいます。素焼き版がなくなると、亜鉛板上で次の反応が起こります。
そのため、自己放電が生じ、電子は外の回路に流れなくなります。
なぜ完全に仕切ってはいけないの?
ダニエル電池を素焼き板ではなく、完全に仕切ってしまうと電流は流れなくなります。仕切ってしまうと、両極間でイオンが動くことができなくなるためです。イオンが動けなくなると、各極でのイオンの総電荷がつりあわず、電気が流れなくなります。
もっと詳しく!
両極を仕切ると、溶けだしたイオンが動かなくなります。亜鉛板では、Znが溶けだすので、[Zn2+]>[SO42-]となります。一方、銅板ではCuが析出することで[SO42-]>[Cu2+]となります。負極ではZn2+が留められ、亜鉛板の電子がZn2+に引き寄せられて動けなくなります。また、銅板周辺では陰イオンが多く、負極からの電子の動きがストップします。この結果、電流は流れなくなります。
しかし、仕切りではなく、素焼きの板にすることによってイオンが移動し、Zn2+はCuSO4側へ、SO42-はZnSO4側へと移動します。この結果、電子が亜鉛板に固定されることがなくなり、銅板側へと移動し始めます。
しかし、Zn2+とSO42-とでは、SO42-の方が移動速度が僅かに早いことが知られています。その結果、やはり両液の間で電位の偏りが生じ、分極します。
ダニエル電池と塩橋
素焼きの板を使う代わりに、塩橋を使う方法もあります。塩橋にはKClやKNO3などの塩の濃水溶液をU字管に入れてゼラチンで固めたものです。
ダニエル電池が放電を始めると、ZnSO4水溶液へはCl–が移動し⊕電荷が中和されます。また、CuSO4水溶液にはK+が移動し⊖電荷を中和します。その結果、両極付近での電位は維持され、分極は殆ど生じません。
塩橋のKClが無くなるとどうなるの?
KClは流出し続けているため、量が減っていきます。次第に濃度が薄くなると、電流が流れなくなります。

ああ
thanks